
ANTICORPI
Cosa sono gli anticorpi? Gli anticorpi (Ig) sono delle immunoglobuline prodotte e secrete nel sangue dai linfociti B a seguito della loro maturazione a plasmacellule indotta dall’esposizione ad un antigene.
Gli anticorpi sono formati da due catene leggere e due catene pesanti che si assemblano a dare una struttura ad Y (sono eterodimeri).
Abbiamo 5 classi di Ig ( dette isotipi) che sono A,G,M,D ed E. I diversi isotipi vengono identificati grazie alla catena pesante di cui abbiamo cinque varianti principali (α, δ, ε, γ, μ) ed eventuali altri sottotipi. Per quanto riguarda le catene leggere invece abbiamo solo due varianti k e λ.
Nel sangue oltre ad avere i diversi isotipi ritroviamo anche una miriade di idiotipi differenti; l’idiotipo è individuato dalla porzione variabile, peculiare per un certo epitopo espresso da un antigene. Ogni immunoglobulina quindi, pur avendo lo stesso idiotipo (determinato da una struttura che si trova sulla catena pesante) ha un diverso isotipo, ossia una porzione variabile che si sviluppa in modo tale da essere indirizzata verso un particolare epitopo.
I diversi idiotipi dipendono dall’esposizione del linfocita B con l’antigene e dal riarrangiamento genico che avviene al suo interno. Studiando le zone del nostro genoma in cui si trovano le sequenze che codificano per le Ig si è osservato che:
- Sul cromosoma 14 abbiamo le sequenze che codificano per le catene pesanti; le sequenze a disposizione per la produzione della porzione variabile della catena pesante sono 100, poi abbiamo le sequenze che codificano per i segmenti J (joining) ed infine le sequenze che codificano per la porzione costante.
- Sul cromosoma 22 le sequenze che codificano per la catena leggera λ; abbiamo 30 segmenti per la produzione della porzione variabile, sequenze che codificano per J e geni che codificano per la porzione costante.
- Sul cromosoma 2 le sequenze che codificano per la catena leggera k; abbiamo 35 segmenti per la produzione della porzione variabile, sequenze che codificano per J e geni che codificano per la porzione costante.
Durante la maturazione della plasmacellula abbiamo un riarrangiamento delle sequenze che codificano per la regione variabile (parliamo di IgG perché è l’isotipo con cui si producono gli anticorpi monoclonali). Durante la maturazione di ogni catena, si ha l’unione solo di alcuni dei segmenti che codificano per il tratto variabile V e il tratto di giunzione J, motivo per cui possiamo dire che l’idiotipo dipende dal riarrangiamento dei tratti genici V-J. Questo processo avviene per la porzione variabile di ogni catena che forma l’anticorpo.
All’interno dei 2 domini variabili (VL e VH ) vi sono tre regioni non contigue denominate CDR (CDR1-2-3), ossia regioni determinanti la complementarietà. Le CDR sono altamente variabili e consentono il legame selettivo fra l’anticorpo ed un antigene specifico.
Ogni anticorpo è quindi un eterodimero formato da due catene pesanti (50 kDa) e due catene leggere (25kDa), ognuna delle quali possiede una porzione variabile e una porzione costante. Sia le catene leggere che quelle pesanti sono unite tramite ponti disolfuro S-S. Lungo la molecola sono presenti delle conformazioni circolari chiamate domini delle Ig.
In prossimità dell’estremità della porzione variabile di entrambe le catene abbiamo residui di NH2 in cui è presente il sito di legame per l’antigene. Le porzioni costanti della catena pesante sono invece individuate da CH1, CH2 E CH3, mentre nella catena leggera abbiamo solo CL.
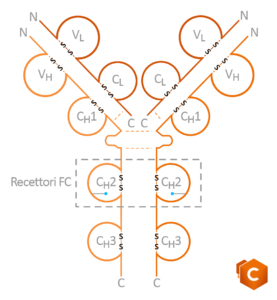
La porzione variabile è quindi il sito di legame per l’antigene e all’interno di questa troviamo le regioni determinanti la complementarietà CDR, anche dette regioni ipervariabili. Le CDR delle catene pesanti e delle catene leggere non sono uguali tra loro. Studiando la loro configurazione 3D si è osservato che le regioni variabili sono composte da foglietti β uniti tra loro da alcune anse, le CDR, che permettono l’interazione specifica con l’epitopo.
Sulla porzione CH2 ritroviamo due siti di legame: uno per il recettore FcγR, sito in cui vengono reclutate le cellule effettrici ADCC (neutrofili, macrofagi e NK) e uno per il recettore C1q, in grado di reclutare le proteine del complemento.
Ogni braccio dell’anticorpo lega una molecola di antigene, per cui gli anticorpi sono bivalenti.
Sulla regione costante troviamo anche il sito di legame per FcRn, il così detto recettore di riciclo, responsabile dell’emivita dell’anticorpo; FcRn è il recettore neonatale per il frammeto Fc, così chiamato perché scoperto inizialmente nell’intestino dei rattini appena nati in fase di allattamento durante uno studio per capire come le Ig passassero dall’intestino al sangue (immunità materna). Le IgG presenti nel latte raggiungono l’intestino e vengono internalizzate dall’epitelio intestinale, dove all’interno dell’endosoma precoce a pH acido formano un legame con FcRn. Il legame fa sì che l’endosoma contenente l’anticorpo non si fonda con il lisosoma ma che invece raggiunga il versante esposto verso il sangue. Il complesso viene quindi riciclato, si fonde con la membrana plasmatica e a pH 7 le IgG vengono re-immessa nel torrente. L’espressione di questo recettore si spegne nell’intestino dell’adulto ma rimane accesso nell’endotelio e nei monociti.
Le funzioni svolte dagli anticorpi sono quindi:
- Richiamare le funzioni effettrici del SI
- Attivare una risposta immunitaria di per sé à stimolazione o inibizione diretta dell’antigene
Se l’antigene è solubile e circola nel sangue, la funzione dell’anticorpo sarà quella di sequestrare le molecole dalla loro funzione biologica, spegnendo quindi l’attività del fattore che è stato legato.
Se l’antigene è invece un recettore di membrana significa che l’anticorpo può variare la sua funzione, per cui o spegne la proteina oppure causa un cambio di conformazione della proteina, la quale invierà segnali alla cellula.
Questi erano gli anticorpi 😊 Speriamo che tu possa aver trovato utile questo nostro articolo. Se hai domande o commenti non esitare a scrivere qui sotto!
No Comments