
Ibridazione carbonio
Che cos’è l’ibridazione?
L’ibridazione è una teoria che i chimici teorici hanno creato per spiegare ed interpretare alcuni parametri sperimentali (lunghezza di legame ed energia di legame in particolare). Questa teoria si rifà a quella quantomeccanica ondulatoria e in particolare spiega come il carbonio, elemento alla base di ogni biomolecola, sia in grado di formare 4 legami covalenti. Per rendere questo possibile sono stati introdotti i modelli di ibridizzazione degli orbitali atomici e degli orbitali molecolari.
Per capire cos’è un orbitale ibrido è necessario prima conoscere la definizione di orbitale, che è una funzione d’onda che descrive il comportamento di un elettrone in un atomo, più precisamente è la regione dell’atomo in cui ho la maggior probabilità di trovare un elettrone.
Esistono diversi tipi di orbitali, rispettivamente detti:
- s, che contiene al massimo 2 elettroni
- p, che contiene al massimo 6 elettroni
- d, che contiene al massimo 10 elettroni
- f, che contiene al massimo 14 elettroni
Ognuno di questi è descritto da precisi numeri quantici a cui corrispondo precisi livelli di energia; ogni orbitale può contenere al massimo due elettroni, ognuno di essi determina una specifica geometri e per ogni tipologia di orbitale abbiamo un diverso numero di elettroni possibili (sempre tenendo presente che per il principio di esclusione di Pauli un orbitale può ospitare al massimo due elettroni con spin antiparallelo). Per passare da un tipo di orbitale all’altro gli elettroni richiedono energia.
Gli orbitali vengono rappresentati graficamente tramite dei quadratini:
- s come un quadratino unico
- p, come 3 quadratini uniti
- d, come 5 quadratini uniti
- f, come 7 quadratini uniti
Con questa convenzione grafica è possibile disegnare la configurazione elettronica di ogni molecola; considerando l’orbitale ad energia più bassa s sempre saturo (solo H ed He possiedono solo un elettrone di valenza), gli altri elettroni appartenenti allo stesso sottolivello (p, d o f), nella condizione di maggior stabilità dell’atomo (condizione di minor energia), tendono ad assumere spin parallelo (regola di Hund) e, poiché in un orbitale possono “convivere” due elettroni solo se hanno spin opposto, ogni orbitale del sottolivello viene prima occupato da un solo elettrone e il secondo elettrone completa l’orbitale solo se prima tutti gli orbitali del sottolivello contengono già un elettrone. In parole povere gli elettroni tendono ad occupare tutto lo spazio libero in modo da stare i più “larghi” possibile.
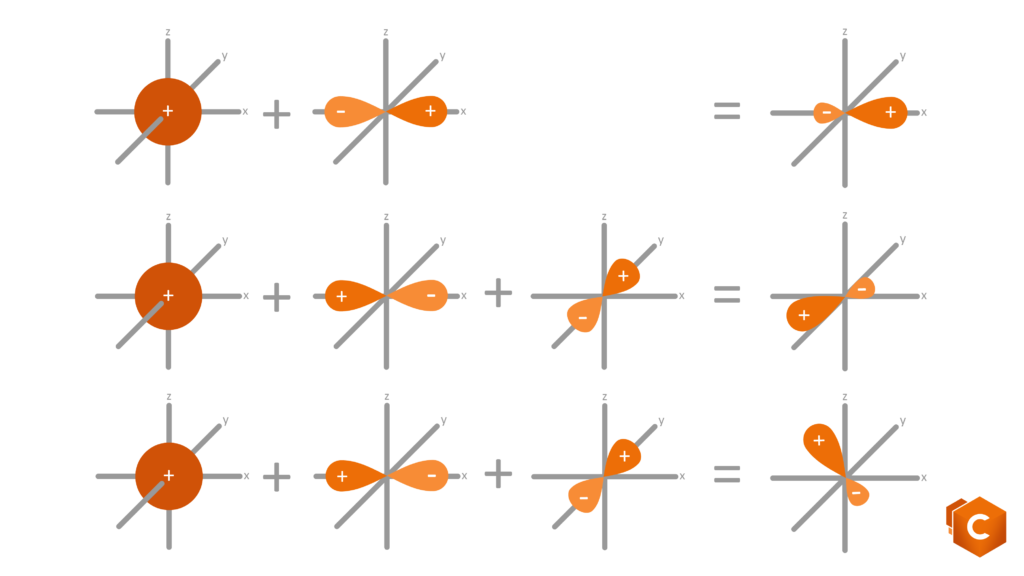
Torniamo al carbonio: l’atomo di C possiede 6 elettroni di valenza, rispettivamente 1s2, 2s2 e 2p2. Disegnando questa configurazione elettronica vediamo che è rimasto in 2p2 solo un altro quadratino libero su tre. Come fa il carbonio, con un solo spazio libero per ospitare l’elettrone, a formare quindi 4 (e non 3) legami covalenti? la risposta ci è data grazie agli orbitali ibridi; gli orbitali del secondo livello infatti (2s2 e 2p2) subiscono un rimescolamento che da luogo a 3 possibili configurazioni per cui gli elettroni si dispongono in 4 orbitali isoenergetici (quattro quadratini sullo stesso livello) ottenuti dalla promozione dell’orbitale 2s al livello del 2p. Questi nuovi orbitali sono detti ibridi in quanto possiedono caratteristiche intermedie tra gli orbitali s (sferici) e gli orbitali p (bilobati).
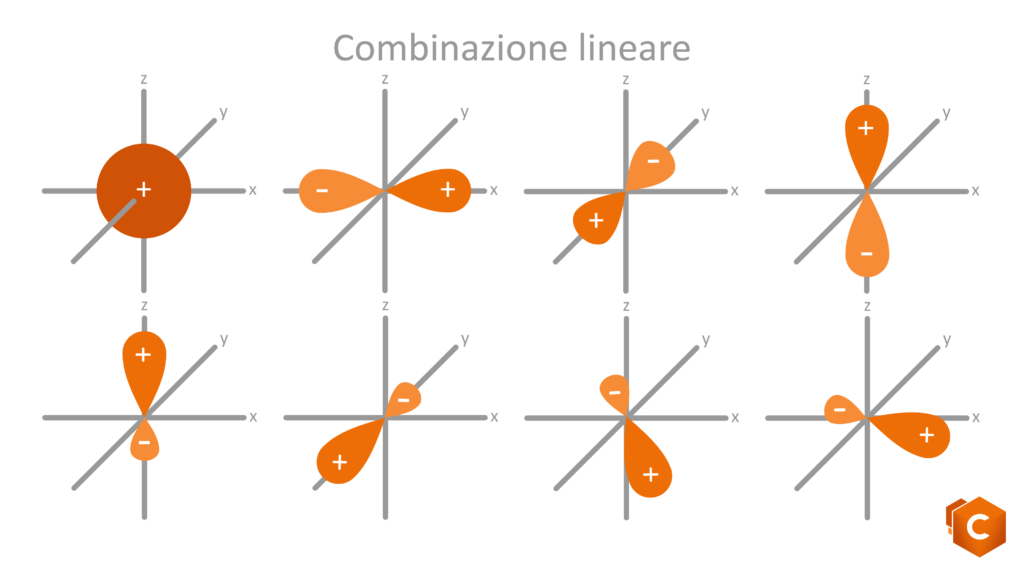
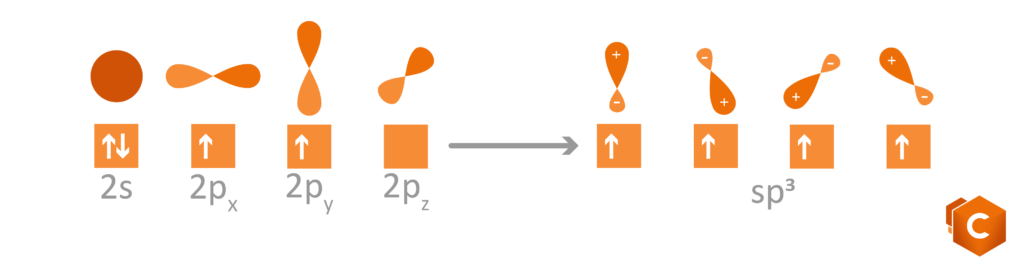
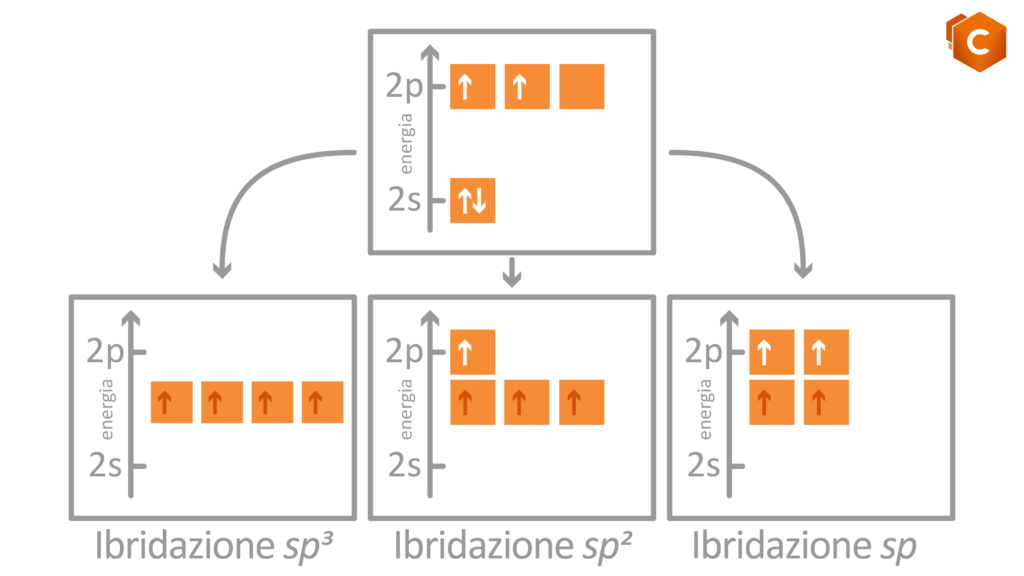
Le possibili ibridazioni sono quindi 3:
- sp: si formano solo 2 dei 4 possibili orbitali ibridi; i due sono orientati simmetricamente su una linea a dare un angolo di 180° che identifica la struttura lineare (gli altri due orbitali p si dispongono perpendicolarmente al piano).
- sp2: si formano 3 orbitali ibridi che si dispongono in modo da formare tra di loro angoli di 120°, i quali identificano la struttura planare (il rimanente orbitale p si dispone perpendicolare al piano).
- sp3: si formano 4 orbitali ibridi che si dispongono verso i vertici di un tetraedro; gli angoli che formano sono di 109.5° e determinano la struttura tetraedrica
Questa era l’ibridazione del carbonio 😉
Speriamo tu possa aver trovato utile questo nostro articolo.
Se hai domande o commenti non esitare a scrivere qui sotto!
No Comments